Koichi Mitsudo,* Nanae Habara, Yoshiaki Kobashi, Yuji Kurimoto, Hiroki Mandai, Seiji Suga*
Synlett 2020, 31, 1947–1952.
DOI: 10.1055/s-0040-1707280
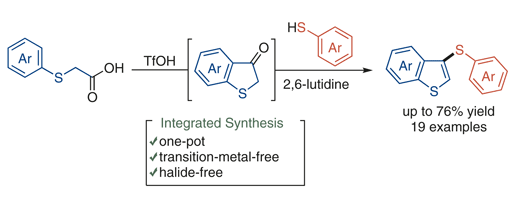
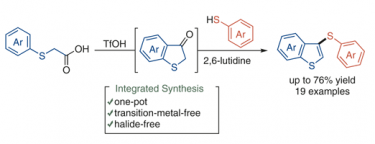
羽原さんが苦労してまとめてくれた研究がSynlett誌に掲載されました。ベンゾチオフェノンを系中で発生させ、これをone-potでチオエーテルへと変換する反応です。ベンゾチオフェノンは空気中で徐々に酸化されてチオインジゴになる分子なので、系中で発生させ、これを空気中に出すこと無く、チオエーテルへと変換しています。チオエーテルは生物活性物質によく見られる骨格の一つです。
このようなジアリールチオエーテルを作る手法としては、一般的には遷移金属触媒を用いたハロゲン化アリールとチオールのクロスカップリング反応が用いられますが、この反応は遷移金属もハロゲンも必要としない系となっています。一段階目で過剰量の酸が必須で、二段階目では触媒量の酸が必要な反応となっているので、二段階目で塩基を入れて過剰量の酸を中和するのがポイントです。
得られたチオエーテルは、Pd触媒を用いた脱水素型環化反応により、縮環できます。この段階は遷移金属を使う必要がありますが、連続反応を検討する中で、通常は塩基を加えない脱水素型の反応系であるにもかかわらず、塩基を添加すると基質の分解が抑制され、縮環生成物が収率よく得られることを見いだしました。前半では遷移金属フリーを謳いながら、後半では遷移金属触媒の改良反応系を構築するという盛りだくさんの論文になっています。